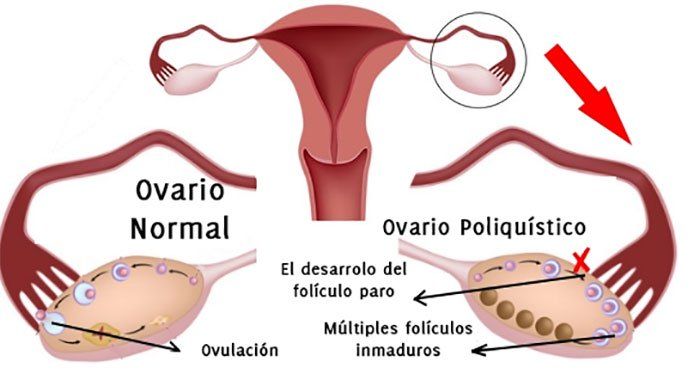
El Síndrome de Ovario Poliquístico (SOP) constituye uno de los principales trastornos endocrinos presentes en mujeres en edad reproductiva con una prevalencia que oscila entre el 8,7 y el 17,8%. El fenotipo de esta enfermedad es muy diverso, sin embargo todas las mujeres con SOP presentan ovarios de morfología poliquística, anovulación, hiperandrogenismo y anomalías gonadotrópicas, convirtiéndose en la causa más común de infertilidad anovulatoria. En el SOP es frecuente encontrar anomalías metabólicas y hormonales relacionadas con la obesidad, la diabetes mellitus tipo 2 y la dislipidemia, llevando a la aparición de síndrome metabólico, generando un mayor riesgo de desarrollar enfermedad cardiovascular. Por la complejidad del SOP, el desconocimiento que existe aún sobre su etiología y la gran frecuencia de presentación se busca en esta pequeña revisión mirar un poco el panorama sobre el componente genético y la implicación etiológica que tiene en este síndrome1,2.
El SOP es una enfermedad multifactorial, en donde participan diversos factores ambientales y genéticos, se han asociado anormalidades en la esteroidogénesis ovárica y el desarrollo folicular en su aparición, así como los impulsos de la hormona liberadora de gonadotropina, a un exceso de hormona luteinizante y a una secreción insuficiente de la Hormona Folículo Estimulante (FSH, según sus siglas en inglés), lo cual ayuda a la producción excesiva de andrógenos ováricos y a la disfunción ovulatoria, esta sobreproducción androgénica también se ve favorecida por la hiperinsulinemia producto de la resistencia a la insulina. En cuanto a los estudios genéticos se han visto comprometidos diversos genes como los implicados con los receptores de gonadotropina, la subunidad beta de la FSH, el receptor de insulina, el gen DENND1A y la hormona antimuleriana2.
En el estudio realizado por Tao Du y colaboradores3 se analizó la asociación entre los polimorfismos del gen del receptor de la FSH y la morfología del ovario poliquístico presente en el SOP, en una población de mujeres chinas, fueron realizadas varias pruebas bioquímicas con el fin de medir niveles de distintas hormonas sexuales, colesterol, glucosa y sensibilidad a la insulina. El receptor de la FSH se expresa en la granulosa y epitelio de las células de la superficie ovárica de los folículos estimulados de las mujeres con SOP, este es miembro de la familia de receptores de proteína G y el gen que lo codifica se encuentra ubicado en el cromosoma 2p21 y esta compuesto por 10 exones y 9 intrones. Una sobre expresión del receptor para la FSH conlleva a un aumento de las células epiteliales en la superficie ovárica generando más folículos prematuros, por lo cual se considera que los polimorfismos o los Polimorfismos de un Único Nucleótido (SNPs, según sus siglas en inglés) están asociados. Varios estudios se han realizado con el fin de identificar estos polimorfismos encontrando c.919A>G (rs6165), sugiriendo que el primero de estos SNPs es un modulador de la respuesta ovárica. Además, en un estudio in vitro realizado en el 2014 por Casarini y colaboradores se confirmó que este polimorfismo resulta en la modulación de la esteroidogénesis en células de granulosa, encontrándose implicado en la patogenesis del SOP4,5,6.
Otro de los genes relacionados con la aparición de SOP en mujeres asiáticas y europeas es el gen DENND1A perteneciente a la familia connecdenn, los cuales se unen a la clatrina y al adaptador de clatrina-2 cumpliendo la función de factores de intercambio de nucleótidos de guanina para la GTPasa endosómica RAB35. La sobreexpresión del gen DENND1A genera un aumento de la biosíntesis de andrógenos por parte de las células de la teca, por lo que se asocian SNPs de este gen con el establecimiento del fenotipo de SOP hiperandrogénico; esto es una hipótesis aún sin comprobar ya que se han realizado estudios similares a los anteriores en población árabe encontrando que no hay una asociación entre el SOP y el gen DENND1A, concluyendo que lo más probable es que los mecanismos metabólicos compensatorios dependan del origen genético, pero hace falta investigaciones con poblaciones más representativas que permitan conocer la asociación de este gen con el SOP4,7,8.
El gen del receptor insulínico se ha asociado con fuerza al hiperandrogenismo, resistencia a la insulina, acantosis nigricans, obesidad y anovulación, signos y síntomas presentes en el SOP, por lo cual se ha asociado este gen con la fisiopatología del mismo, ya que refleja la importancia de la resistencia a la insulina en la modulación de las características de este síndrome4.
El componente genético del SOP no está totalmente definido, se requieren de investigaciones con una gran diversidad de población y muestra representativa para aclarar cuales son los principales SNPs generadores de esta patología, sin embargo se ha intentado generar una derivada genética a la distribución de los marcadores genéticos del SOP. En este estudio evolutivo se analizaron las frecuencias de los SNPs vinculados a la enfermedad de muestras tanto femeninas como masculinas, en donde se encontró que los genotipos relacionados con la enfermedad estaban representados de manera diferente entre los continentes, dando lugar a una distribución peculiar que se correspondía con las principales áreas geográficas. Así mismo se calculó la heterocigosidad de los marcadores del SOP sugiriendo que estos fueron sometidos a una presión selectiva que afectó a la decadencia de la heterocigosidad, aunque la derivada genética contribuyó a la distribución cualitativa y que tomados en conjunto, estos resultados apoyan la hipótesis de que el SOP acompaña a los seres humanos en su evolución4,9.
En conclusión la genética en el SOP en la actualidad se ha explorado con diversas investigaciones, sin embargo no se ha podido exponer con claridad un genotipo específico relacionado con esta patología por lo cual se siguen realizando estudios con el fin de aclarar este enigma científico.
Agradecimientos
Pertenecer a la Revista Medicas UIS ha sido una de las experiencias más gratificantes en mi formación como médica, quiero agradecer a todos mis compañeros editores por acogerme y acompañarme en este bonito proceso, espero que esta revista de estudiantes constituida como la más antigua de Latinoamérica siga progresando y alcanzando grandes logros con el esfuerzo, la dedicación y el amor de cada uno de sus editores.
Karen Julieth Torres-Rodríguez1
Óscar Leonardo Torra-Baraja2
1 Estudiante de IX Semestre de Medicina. Escuela de Medicina. Facultad de Salud. Universidad Industrial de Santander. Ex editora Revista Médicas UIS. Departamento Editorial. Bucaramanga. Santander. Colombia.
- 2. Médico. Universidad Autónoma de Bucaramanga. Facultad de salud. Bucaramanga. Santander. Colombia.
Correspondencia: Sra. Karen Julieth Torres Rodríguez. Dirección: Calle 32 # 32-70 Torre A apartamento 101 Bucaramanga. Santander. Colombia.
Referencias Bibliográficas
- Lopes de AndrAde V, Oliveira A, Soares R, Costa-Silva D, Mota L, Pinheiro P. Current aspects of polycystic ovary syndrome: A literature review. Rev Assoc Med Bras 2016; 62(9):867-871
- McCartney CR, Marshall JC. Polycystic Ovary Syndrome. N Engl J Med 2016;375:54-64.
- Du T, Duan Y, Li K, Zhao X, Ni R, Li Y, Yang D. Statistical Genomic Approach Identifies Association between FSHR Polymorphisms and Polycystic Ovary Morphology in Women with Polycystic Ovary Syndrome. Biomed Res Int. 2015;2015:483726
- Casarini L, Simoni M, Brigante G. Is polycystic ovary syndrome a sexual conflict? A review. Reprod Biomed Online. 2016;32(4):350-61
- Simoni M. Casarini L. Mechanisms in endocrinology: genetics of FSH action: a 2014-and-beyond view. Eur J Endocrinol. 2014;170(3):R91-107.
- Casarini L. Brigante G. The polycystic ovary syndrome evolutionary paradox: a genome-wide association studies-based, in silico, evolutionary explanation. J. Clin. Endocrinol. Metab. 2014;99(11):E2412–2420.
- Chen Z.J. Zhao H. He L. Shi Y. Qin Y. Shi Y. Et al. Genome-wide association study identifies susceptibility loci for polycystic ovary syndrome on chromosome 2p16.3, 2p21 and 9q33.3. Nat Genet. 2011;43(1):55-9
- Gammoh E. Arekat M.R. Saldhana F.L. Madan S. Ebrahim B.H. Almawi W.Y. DENND1A gene variants in Bahraini Arab women with polycystic ovary syndrome. Gene. 2015; 560(1):30-3.
- Henn B.M. Cavalli-Sforza L.L. Feldman M.W. The great human
Para descargar la investigación completa haga clik a continuación:
http://revistas.uis.edu.co/index.php/revistamedicasuis/article/view/6436/7025